行政と企業の双方による新たな「協働計画」により、世界最速レベルの審査期間を維持し、規制と審査の最適化を目指す
2021年5月20日
有効で安全な医療機器をより早く医療の現場に届けるためには、医療機器の審査期間を短縮することが課題のひとつです。2014~2018年度に「医療機器審査迅速化のための協働計画」が行われ、審査期間は大きく短縮し、世界最速レベルを達成しました。現在は、この水準を維持しつつ、医療機器開発プロセスと規制の最適化を目指す新たな協働計画が行われています。
- 「医療機器審査迅速化のための協働計画」
- 審査側である行政と申請側である企業が双方に協働しながら、審査と申請の質の向上を目指すことで、医療機器の承認までの期間の短縮と審査期間の標準化を図るもので、2014~2018年度に行われました。これは2009~2013年度に行われた「医療機器の審査迅速化アクションプログラム」を引き継ぐ形で実施されたものであり、2019年度からは新たに「医療機器規制と審査の最適化のための協働計画」が5年計画で進められています。
Point
- 審査の迅速化を図るために、審査側である行政と申請側である企業の協働によって2014~2018年度に「医療機器審査迅速化のための協働計画」が実施された
- 双方の協働の結果、すべての医療機器の分類で審査期間が短縮され、最終年度にはほぼすべての分類で目標値を達成した
- この審査期間の水準を維持しつつ、現在は「規制と審査の最適化」を目標とした新たな協働計画が進められている
行政側・企業側の双方による審査迅速化のための協働計画
有効で安全な医療機器をより早く医療の現場に提供するためには、医療機器の承認までの期間を短縮することが重要な課題です。この課題を克服するため、2009~2013年度に審査側の行政と申請側の企業の双方が協働するという「医療機器の審査迅速化アクションプログラム」が実施され、医療機器承認までの期間は短縮し、デバイスラグ(特定の医療機器の日本への導入が欧米諸国に比べ遅れている状態)の解消にも多大な貢献を果たしました。
2014~2018年度にはさらなる審査迅速化のため、審査員や申請者への研修の充実などといった審査と申請の質の向上が盛り込まれた「医療機器審査迅速化のための協働計画」が実施されました。本計画でも審査期間の目標値を掲げており、開始年度と最終年度の調査結果を比較すると、すべての申請カテゴリーで審査期間が短縮され、最終年度にはほぼすべての申請カテゴリーで目標値が達成されました(図)。
また、2014~2018年度には体外診断用医薬品(IVD)の承認までの期間の短縮を図る「体外診断用医薬品審査迅速化のための協働計画」も行われました。本計画の結果、すべての申請カテゴリーで審査期間の目標値が達成されました。
医療機器の申請から承認までの審査期間の比較(申請コホート80%タイル値)
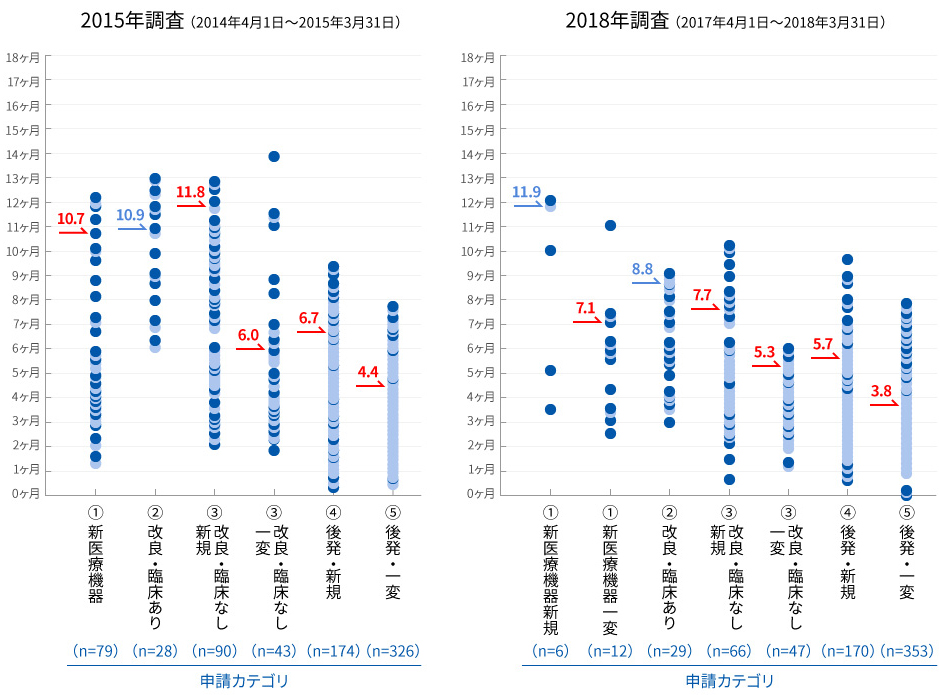
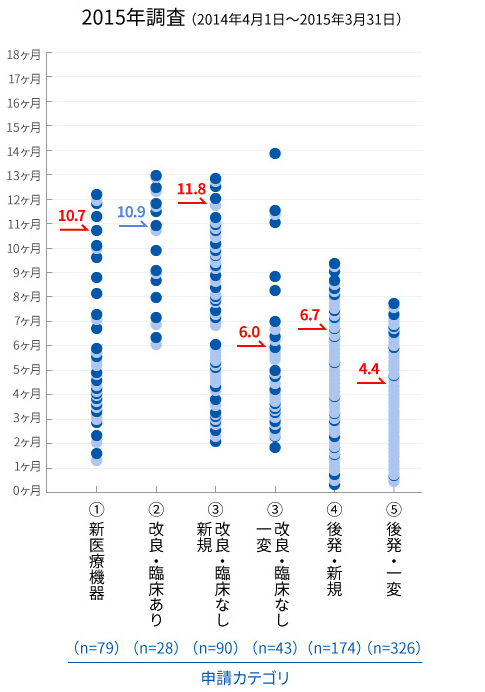
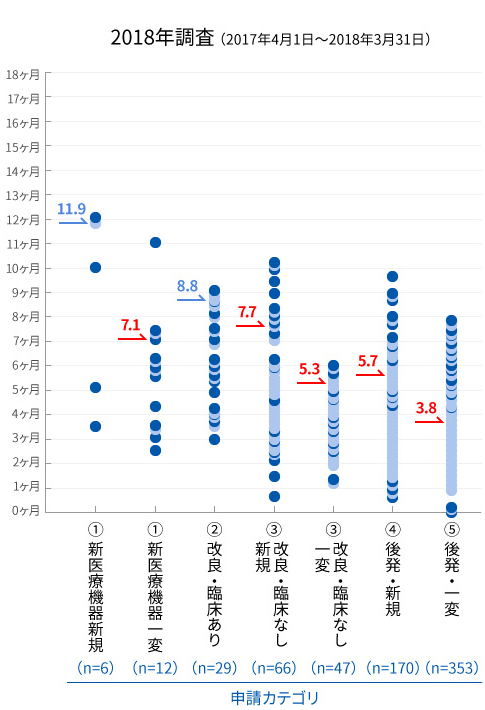
※グラフ内の矢印が示す値は、総審査期間の80%タイル値。但し、青字は処理率が80%未満の値
(出典)AMDD10周年記念誌『AMDD 10年の軌跡と未来への提言』
世界最速レベルの審査期間水準の維持と、規制と審査の最適化を目指す新たな協働計画
これまでの協働計画でのさまざまな取り組みの結果、日本の医療機器の審査期間は世界最速レベルに到達することができました。そして、新たに2019年度からの5年間では、この審査期間の水準を堅持しつつ、さらに審査と申請の質の向上を目指すべく、「医療機器規制と審査の最適化のための協働計画」が進められています。これまでの協働計画に引き続き、行政側と申請側が協力して活動を推進しています。
また、現在進められている協働計画では、医療機器のデバイスラグを解消するための取り組みも行われています。デバイスラグは、日本と欧米を比較したときの開発期間の遅延をあらわす「開発ラグ」と、審査期間の遅延をあらわす「審査ラグ」のふたつの要素からなります。これまでの協働計画の成果もあり、審査ラグは大幅に解消されましたが、依然として開発ラグは解消されておらず、対策が必要です。現在進められている協働計画では、開発から申請までの期間を短縮することを目的として、開発ラグの把握と必要施策について検討が進められています。
審査の迅速化を実現するために、AMDDはこれまでも行政と協力して協働計画等に取り組んできました。今後も、先進医療技術を迅速に医療現場に導入させるため、引き続き積極的に活動を進めていきます。

